
Illustration af McCall Sarrett
Uanset om det drejer sig om at glemme 20 år af dit liv eller at have den samme samtale hvert femte minut for kun at glemme det hver gang, kan hukommelsessvækkelse tage en stor vejafgift på hverdagen. Det kan være et af de mest forvirrende aspekter af neurodegeneration og er et nøglesymptom på demens.
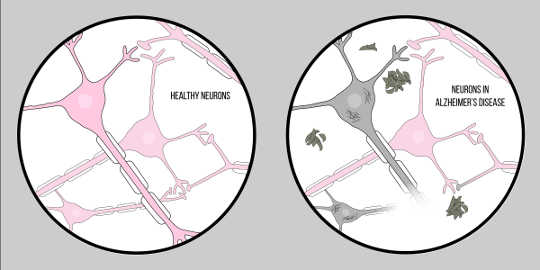
Alzheimers sygdom, også kendt som AD, er den mest almindelige form for demens, karakteriseret ved kognitive vanskeligheder og hukommelsestab. Der er i øjeblikket ingen officiel klinisk teknik til diagnosticering af AD, bortset fra en obduktion. Der er dog to karakteristiske træk ved hjernevævet hos patienter med Alzheimers sygdom: amyloid beta (EN?) plaques og neurofibrillære sammenfiltringer, som begge har givet en betydelig mængde af indsigt i patologien bag neurodegeneration.
"Neurofibrillære sammenfiltringer opstår fra en defekt i proteiner kaldet tau-proteiner."
EN? er et protein, der stammer fra proteolyse of Amyloidprecursorprotein (APP). Det betyder, at APP skæres i mindre fragmenter, hvoraf det ene er A? fragment. APP skæres i disse stykker af enzymer kaldet sekretaser, hvis primære rolle er at spalte disse proteiner. Der findes forskellige sekretaser, men der er en, der har betydning for Alzheimers patologi – gammasekretase. Gamma-sekretase producerer en særlig form af A?: A?-42, den mest toksiske form af proteinet. Når de er brudt op, begynder disse proteinfragmenter at samle sig i rummet uden for cellerne. Nøglen til toksiciteten af disse proteiner er, at de er karakteristisk "klæbrige", så de begynder at danne aggregater. Disse aggregater fortsætter med at udvikle sig, og snart er disse amyloid beta plaques overalt, hvilket i høj grad forringer neuronal funktion.
 Figur af McCall Sarrett
Figur af McCall Sarrett
Denne virkning af A? på neurologisk funktion har ført til Amyloid hypotese, en velkendt teori, der foreslår en forklaring på neurodegenerationen ved Alzheimers.
Nu til den anden nøglekarakteristik: neurofibrillære sammenfiltringer. Neurofibrillære sammenfiltringer opstår fra en defekt i proteiner kaldet tau-proteiner. Tau-proteiner tjener som en bro mellem strukturer kaldet mikrotubuli i cellen. Mikrotubuli er understøttende molekyler, som giver form og struktur til cellerne, specifikt axoner. Tau-proteiner hjælper disse mikrotubuli med at give struktur til axonerne. Dog i tilfælde af Alzheimers sygdomEn neurodegenerativ sygdom karakteriseret ved neuronalt tab i..., tau-proteiner adskilles og akkumuleres i cellekroppen, også kendt som soma. Dette forårsager degeneration af axonerne, hvilket gør det endnu sværere for neuroner at kommunikere. Denne vanskelighed i neuronal kommunikation ligner virkningerne af amyloid beta; det er dog vigtigt at bemærke, at disse sammenfiltringer adskiller sig meget fra de plaques, der blev diskuteret tidligere, ved at de påvirker kommunikationen indefra cellen i modsætning til ydersiden.
"Forskere er stadig usikre på den nøjagtige mekanisme, der er ansvarlig for patologien af Alzheimers."
Selvom begge er ekstremt indflydelsesrige, A? og tau er ikke de eneste relevante faktorer, når det kommer til patologien ved Alzheimers. Undersøgelser har antydet, at Apolipoprotein E (APOE) gen kan være lige så indflydelsesrig som A?. Der er tre hovedvarianter, der koder for proteiner: ApoE2, ApoE3 og ApoE4. ApoE4 har vist sig at korrelere med et fald i synaptisk beskæring, mens ApoE2 resulterer i en stigning. Begge former påvirker astrocytter (vigtig gliaceller i nervesystemet) og er korreleret til deres fagocytosehastighed, den proces, hvorved astrocytterStjerneformede gliaceller, der har en række funktioner, inklusiv... opsluger cellulært materiale. Hver ApoE-variant påvirker direkte denne fagocytosehastighed, ApoE2, hvilket resulterer i en stigning, og ApoE4, et fald. Dette tyder på, at astrocytterne muligvis er mindre i stand til at "rydde ud" det affald, der flyder rundt i cellen, når de er korreleret med ApoE4. Når disse plaques opbygges, kan ApoE4-genotypen således forhindre clearance af disse aggregater, hvilket bidrager til degeneration.
Amyloid beta, tau og forskellige gener arbejder alle sammen om at forårsage et stort kommunikationsproblem mellem celler, som i bund og grund er den sygdom, vi kender som Alzheimers. En sådan neurodegeneration er mest almindelig i områder af hjernen, der er forbundet med indlæring og hukommelse, men spreder sig til sidst gennem hele hjernen. Med denne mangel på kommunikation kommer et tab af synapser, og i sidste ende et fald i hjernestof. Det er således normalt at se nedsat hjernevæv på en MRIMagnetisk resonansbilleddannelse, en teknik til at se strukturen... efterhånden som sygdommen skrider frem, og afslører, at Alzheimers bogstaveligt talt krymper hjernen. Vores nuværende modeller for læring og hukommelse angiver, at synapser spiller en nøglerolle i disse processer, hvilket giver en mulig forklaring på, hvordan denne patologi korrelerer med de vigtigste symptomer på AD, såsom hukommelsestab.
Forskere er stadig usikre på den nøjagtige mekanisme, der er ansvarlig for patologien af Alzheimers. Mange innovative metoder er blevet undersøgt i et forsøg på at få yderligere viden om dette patologiske punkt, en er cerebrospinalvæske (CSF) biomarkører.
Niveauer af A? og tau kan måles i CSF gennem en procedure kaldet en lumbalpunktur, som opsamler cerebrospinalvæske. Forøgede niveauer af tau og reducerede niveauer af A? ses hos patienter med Alzheimers sygdom. Dette er et resultat af A? ophobninger i hjernen, hvilket igen resulterer i en nedsat koncentration i CSF. Disse data tyder på, at læger og videnskabsmænd i fremtiden muligvis vil være i stand til at forudsige en patients kognitive tilstand ved at undersøge proteinniveauer i CSF.
I øjeblikket er der ingen endelig kur mod Alzheimers sygdom. Alligevel giver stigende viden om de involverede patologiske proteiner, associerede gener og igangværende videnskabelig forskning håb om en effektiv behandling i fremtiden.
Hvilket gennembrud mener du, der skal til, for at medicin kan opnå en behandling af Alzheimers? Fortæl os det i kommentarerne!
Denne artikel blev oprindeligt vist på Kendte neuroner?
Om forfatteren
Khayla Black er en førsteårsstuderende ved New York University Shanghai, der planlægger at erklære en hovedfag i Neural Sciences med en bifag i Data Science med en koncentration i kunstig intelligens. I fremtiden håber hun at få en MD/PhD og blive neuroforsker, der studerer de molekylære aspekter af indlæring og hukommelse. I sin fritid nyder Khayla at arbejde med MYELIN-initiativet inden for IYNA såvel som at læse alt neurovidenskabsrelateret materiale. Ud over at studere neurovidenskab nyder hun at løbe, undervise på lokale folkeskoler, løse matematiske problemer og drikke enorme mængder kaffe.
Relaterede bøger
at InnerSelf Market og Amazon
Referencer
Lacor, PN, Buniel, MC, Furlow, PW, Clemente, AS, Velasco, PT, Wood, M., . . . Klein, WL (2007, 24. januar). EN? Oligomer-inducerede aberrationer i Synapse Sammensætning, form og tæthed giver et molekylært grundlag for tab af forbindelse ved Alzheimers sygdom. Hentet fra http://www.jneurosci.org/content/27/4/796
Murphy, MP, & LeVine, H. (2010). Alzheimers sygdom og ?-amyloidpeptidet. Journal of Alzheimer's Disease?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ, & Wong, PC (2011). Amyloid Precursor Protein Processing og Alzheimers sygdom. Årlig gennemgang af neurovidenskab, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, … Barres, BA (2016). Ny allelafhængig rolle for APOE i at kontrollere hastigheden af synapseForbindelser mellem neuroner, hvor et signal sendes fra af... beskæring af astrocytter. Forsøg af National Academy of Sciences i USA, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, 19. august). Amyloid? og APP som biomarkører for Alzheimers sygdom. Hentet fra https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























