
Du ser det i reklamer hver dag: cremer og lotioner til at reducere rynker, farvestoffer til at fjerne grå hår og midler til at reducere muskel- og ledsmerter. Sammen med disse ændringer i overfladeniveauet påvirker det at blive ældre også kroppens indre fysiologi, herunder øget inflammation i hjernen (Czirr & Wyss-Coray, 2012), degeneration i nethinden (Hoh Kam et al, 2010) og permeabilitet af tarmvæggene (Ma et al, 1992). Mange industrier er bygget med det mål at vende tegnene på aldring. Men er der en måde at modvirke virkningerne af aldring i kroppen på et dybere plan end at farve dit hår? En gruppe videnskabsmænd foreslår en unik måde at skrue tiden tilbage på aldringsrelaterede konsekvenser i hjernen ved hjælp af fækal mikrobiota-overførsel (FMT; Parker et al., 2022).
FMT bruger principperne for parabiose (Se en kendt artikel om Knowing Neurons link.!) at bytte tarmmikrobiomer, defineret som hele bakterier og mikroorganismer, der lever i den raske tarm (Sommer et al, 2013), mellem gamle og unge mus. For at teste deres hypotese om, at brug af FMT til at ændre tarmmikrobiomet ændrer betændelse i hjernen og kroppen, brugte Parker og kolleger en musemodel med 3 måneder gamle mus (unge mus) og 24 måneder gamle mus (gamle mus) ). Før eksperimentet startede, indsamlede forskerne først fækalt stof for at etablere basislinjen for unge og gamle musemikrobiomer. Bagefter fik mus antibiotika i tre dage for at reducere bakterierne i deres tarme. Efter antibiotikabehandlingen indsamlede forskerne endnu en afføringsprøve. Efter disse indledende trin blev der udført to runder FMT, hvor flydende afføring blev givet nasalt, og mus blev anbragt i bure indeholdende afføring i henhold til deres forsøgsgruppe. De eksperimentelle grupper i denne undersøgelse var gamle mus, der modtog FMT fra unge mus og unge mus, der modtog FMT fra gamle mus, mens kontrolgrupperne var unge mus, der modtog FMT fra andre unge mus eller en ikke-fækal kontrolopløsning (kaldet unge kontrolmus) og gamle mus, der modtager FMT fra andre gamle mus eller en ikke-fækal kontrolopløsning (kaldet gamle kontrolmus). Efter FMT blev afføring indsamlet fem dage og to uger senere. Dette eksperimentelle design gjorde det muligt for efterforskerne at studere, hvordan tarmmikrobiomets alder påvirker processer i hjernen, nethinden og tarmene.
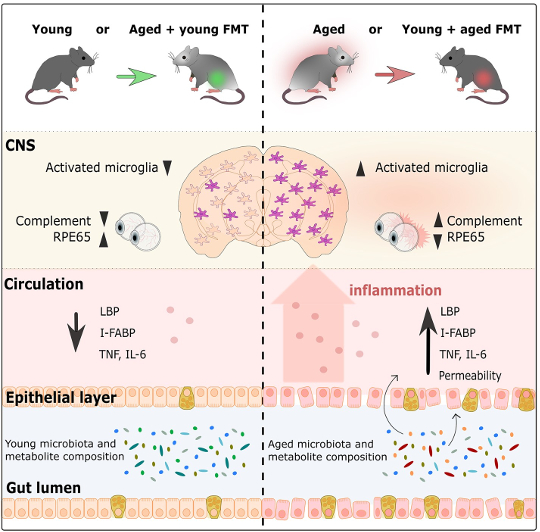
Grafisk abstrakt fra Parker et al., 2022
...infusion af en gammel mus med et ungt mikrobiom fortryder immunresponset set med alderen.
Forskere undersøgte først, hvordan FMT påvirker den inflammatoriske respons af mikroglia, hjernens hjemmehørende immunceller, i cortex og corpus callosum (et enormt bundt af neuroner, der tillader de to sider af hjernen at kommunikere med hinanden) (Heneka et al., 2019) ; Erny et al., 2015). Ældre kontrolmus havde mere aktiveret mikroglia end unge kontrolmus, hvilket afspejler processen med normal aldring. Men gamle mus med unge mikrobiomer havde meget mindre mikroglia-aktivering end gamle kontrolmus. Overraskende nok var mikroglia-responset ret lig det, der blev observeret hos unge kontrolmus. Det samme mønster blev også vist i den modsatte retning, da unge mus med gamle mikrobiomer havde meget mere mikroglia-aktivering end unge kontrolmus, svarende i stedet til niveauerne af aktivering set i gamle kontrolmus. Dette viser, at mikrobiomets alder påvirker immunresponset i hjernen, og at infusion af en gammel mus med et ungt mikrobiom fortryder immunresponset set med alderen. På samme måde accelererer det at give en ung mus et ældet mikrobiom alderens effekt på hjernens immunceller.
... mikrobiomet påvirker aldersrelaterede processer i nethinden ...
Ud over at undersøge hjernen undersøgte forskerne også, hvordan tarmmikrobiomets alder påvirker nethinden. Generelt blev det vist, at sammenlignet med unge mus havde gamle mus øget inflammation i nethinden. Efter FMT havde gamle mus med unge mikrobiomer imidlertid retinale inflammationsniveauer svarende til dem hos unge kontrolmus. I tråd med fundene i hjernen var det modsatte også tilfældet. Unge mus med gamle mikrobiomer havde retinal inflammation, der lignede gamle kontrolmus. Tarmmikrobiomet påvirker også en anden del af det visuelle system: fotoreceptorernes evne til at regenerere i nethinden ved hjælp af RPE65-proteinet, hvis produktion også vides at falde med alderen (Cai et al, 2009). Hos gamle mus med unge mikrobiomer var der en øget mængde af RPE65-proteinet sammenlignet med gamle kontrolmus. Faktisk svarede disse proteinniveauer til niveauerne hos unge mus. Desuden havde unge mus med gamle mikrobiomer meget mindre RPE65 end unge kontrolmus, med proteinniveauer sammenlignelige med niveauer set i gamle mus. Samlet set viser dette, at mikrobiomet påvirker aldersrelaterede processer i nethinden, hvor unge mikrobiomer vender tilbage, og ældede mikrobiomer accelererer processer forbundet med aldring.
Et andet vigtigt organ, tarmene, er heller ikke skånet for virkningerne af aldring: Cellelaget, der danner væggen i tarmene, bliver utæt over tid (Cui et al, 2019; Thevaranjan et al, 2017). I løbet af ældningen falder stabiliteten af tarmvæggen og bliver mere permeabel, hvilket tillader bakterier at lække ud i periferien, hvilket igen øger den samlede inflammation (Cui et al, 2019; Thevaranjan et al, 2017). I denne undersøgelse viste forskerne, at mikrobiomets alder påvirker tarmvæggenes stabilitet. Hos gamle mus med et ungt mikrobiom var tarmene mindre utætte end gamle kontrolmus. Faktisk svarede intestinal permeabilitet i gamle mus med et ungt mikrobiom til permeabiliteten set i unge mus. Ældre mus med unge mikrobiomer havde også niveauer af inflammation og tegn på bakterier i blodet svarende til unge mus. Endnu en gang opførte tarmene på unge mus med gamle mikrobiomer sig på samme måde som gamle mus med gamle mikrobiomer ved at have en mere utæt tarm og mere betændelse end unge mus med unge mikrobiomer. Disse resultater understøtter hypotesen om, at forældede mikrobiomer bidrager til stigningen i tarmpermeabilitet, hvilket letter en stigning i inflammation ved at tillade bakterier at lække ind i blodbanen. Det er vigtigt, at introduktion af et ungt mikrobiom gennem FMT vender disse aldersrelaterede effekter.
… tarmmikrobiomets alder påvirker hjernens, nethinden og tarmens funktioner.
Undersøgelsens resultater viser, at tarmens mikrobiom-alder påvirker funktioner i hjernen, nethinden og tarmen. Men hvordan adskiller unge og gamle mikrobiomer sig fra hinanden? For at besvare dette spørgsmål sekventerede forskerne DNA'et fra mikrobiomet fundet i de fækale prøver, der blev indsamlet i løbet af eksperimentet. Det unge og gamle mikrobiom havde allerede forskellige genetiske sammensætninger, før FMT opstod, men FMT ændrede signifikant den genetiske sammensætning af begge mikrobiomer. Unge mus med gamle mikrobiomer havde en meget lignende sammensætning som gamle kontrolmus, mens den genetiske sammensætning i gamle mus med unge mikrobiomer var forskellig fra gamle kontrolmus og også adskilte sig fra unge mus med unge mikrobiomer - de var et sted midt imellem. Ældre kontrolmus og unge mus med ældede mikrobiomer havde hovedsagelig bakterier fra Oscillibacter , Prevotella slægt, Firmicutes phylum, og Lactobacillus johnsonii arter, mens unge kontrolmus og gamle mus med unge mikrobiomer havde bakterier for det meste fra Bifidobacterium, Ackermansia, Parabacteroides, Clostridiumog Enterokokker grupper. Da forskerne undersøgte den potentielle årsag til disse aldersrelaterede ændringer, fandt forskerne, at veje involveret i lipid- og vitaminproduktion (som er afhængig af metabolitter produceret af bakterier), var forskellige mellem gamle og unge mikrobiomer. Der er én ulempe ved denne observation – ændringerne i mængden af forskellige slags bakterier og deres potentielle funktion i tarmen var ikke langvarige, da der ikke var store forskelle mellem mikrobiomsammensætningen to uger efter FMT.
Samlet set viste denne undersøgelse, at tarmmikrobiomet påvirker aldersrelaterede processer i hjernen, øjet og tarmen. Ældrede mikrobiomer, uafhængigt af modtagermusens alder, førte til mere betændelse i hjernen, nethinden og tarmene, mindre regenereringspotentiale i fotoreceptorer i nethinden, og flere bakterier siver ud af tarmene. På den anden side vendte introduktionen af unge mikrobiomer til gamle mus disse ældningseffekter. Dette kan skyldes forskellene i bakteriesammensætningen af gamle og unge mikrobiomer og den effekt, som disse ændringer kan have på de veje, der er ansvarlige for lipid- og vitaminproduktion. Et spørgsmål, der ikke blev behandlet i denne undersøgelse, var, hvordan mikrobiomalderen påvirker kognitiv ydeevne, da hverken kontrolmus eller FMT-mus opførte sig anderledes i adfærdshukommelsestests. Fremtidig forskning bør også fokusere på dette spørgsmål, da kognition og hukommelse vides at aftage med alderen, og forståelsen af mikrobiomets rolle i aldersrelateret kognitiv tilbagegang kunne give vigtig indsigt i mulige biologiske fundamenter. En anden retning, som fremtidige forskningsspørgsmål bør forfølge, ville være kostens indvirkning på sammensætningen af tarmmikrobiomet. Tidligere undersøgelser har vist, at forskellige diæter ændrer typerne af mikrober i tarmen både på kort sigt (David et al., 2014) og langsigtet (Wu et al., 2011). Hvis ændringer i kosten kan ændre sammensætningen af tarmmikrobiomet, hvad nu hvis det kan reducere disse tegn på aldring i hjernen, nethinden og tarmene?
Hvis ændringer i kosten kan ændre sammensætningen af tarmmikrobiomet, hvad nu hvis det kan reducere disse tegn på aldring i hjernen, nethinden og tarmene?
Om forfatterne
Skrevet af Holly Korthas, Illustreret af Federica Raguseo, Redigeret af Johanna Popp, Sarah Wadeog Lauren Wagner
Referencer
Cai, X., Conley, SM, & Naash, MI (2009). RPE65: rolle i den visuelle cyklus, human retinal sygdom og genterapi. Oftalmisk genetik, 30(2), 57-62. https://doi.org/10.1080/13816810802626399
Cui, H., Tang, D., Garside, GB, Zeng, T., Wang, Y., Tao, Z., Zhang, L., & Tao, S. (2019). Wnt-signalering medierer den aldringsinducerede differentieringsforringelse af intestinale stamceller. Stamcelleanmeldelser og rapporter, 15(3), 448-455. https://doi.org/10.1007/s12015-019-09880-9
Czirr, E., & Wyss-Coray, T. (2012). Immunologien af neurodegeneration. Journal of Clinical Investigation, 122(4), 1156-1163. https://doi.org/10.1172/JCI58656
David, L., Maurice, C., Carmody, R. et al. Kost ændrer hurtigt og reproducerbart det menneskelige tarmmikrobiom. Natur 505, 559-563 (2014). https://doi-org.proxy.library.georgetown.edu/10.1038/nature12820
Erny, D., Hrab? de Angelis, AL, Jaitin, D., Wieghofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T., Schwierzeck, V. ., Utermöhlen, O., Chun, E., Garrett, WS, McCoy, KD, Diefenbach, A., Staeheli, P., Stecher, B., Amit, I., & Prinz, M. (2015). Værtsmikrobiota kontrollerer konstant modning og funktion af mikroglia i CNS. Nature Neuroscience, 18(7), 965-977. https://doi.org/10.1038/nn.4030
Heneka MT (2019). Microglia er i centrum for neurodegenerative sygdomme. Naturanmeldelser. Immunologi, 19(2), 79-80. https://doi.org/10.1038/s41577-018-0112-5
Hoh Kam, J., Lenassi, E., & Jeffery, G. (2010). Se aldrende øjne: forskellige steder med amyloid Beta-akkumulering i den aldrende muse nethinde og opregulering af makrofager. PloS One, 5(10), e13127. https://doi.org/10.1371/journal.pone.0013127
Ma, TY, Hollander, D., Dadufalza, V., & Krugliak, P. (1992). Effekt af aldring og kaloriebegrænsning på tarmpermeabilitet. Eksperimentel Gerontologi, 27(3), 321-333. https://doi.org/10.1016/0531-5565(92)90059-9
Parker, A., Romano, S., Ansorge, R., Aboelnour, A., Le Gall, G., Savva, GM, Pontifex, MG, Telatin, A., Baker, D., Jones, E., Vauzour , D., Rudder, S., Blackshaw, LA, Jeffery, G., & Carding, SR (2022). Fækal mikrobiota-overførsel mellem unge og gamle mus vender kendetegnene for den aldrende tarm, øje og hjerne. microbiome, 10(1), 68.
https://doi.org/10.1186/s40168-022-01243-w
Sommer, F., & Bäckhed, F. (2013). Tarmmikrobiotaen - mestre i værtsudvikling og fysiologi. Naturanmeldelser. Mikrobiologi, 11(4), 227-238. https://doi.org/10.1038/nrmicro2974
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, JC, Verschoor, CP, Loukov, D., Schenck, LP, Jury, J., Foley, KP, Schertzer, JD, Larché, MJ, Davidson, DJ, Verdú, EF, Surette, MG, & Bowdish, DME (2017). Aldersassocieret mikrobiel dysbiose fremmer intestinal permeabilitet, systemisk inflammation og makrofagdysfunktion. Cell vært & mikrobe, 21(4), 455-466.e4. https://doi.org/10.1016/j.chom.2017.03.002
Wu, GD, Chen, J., Hoffmann, C., Bittinger, K., Chen, YY, Keilbaugh, SA, Bewtra, M., Knights, D., Walters, WA, Knight, R., Sinha, R. , Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, FD, & Lewis, JD (2011). Sammenkædning af langsigtede kostmønstre med tarmmikrobielle enterotyper. Science (New York, NY), 334(6052), 105-108. https://doi-org.proxy.library.georgetown.edu/10.1126/science.1208344
Denne artikel blev oprindeligt vist på Kendte neuroner























